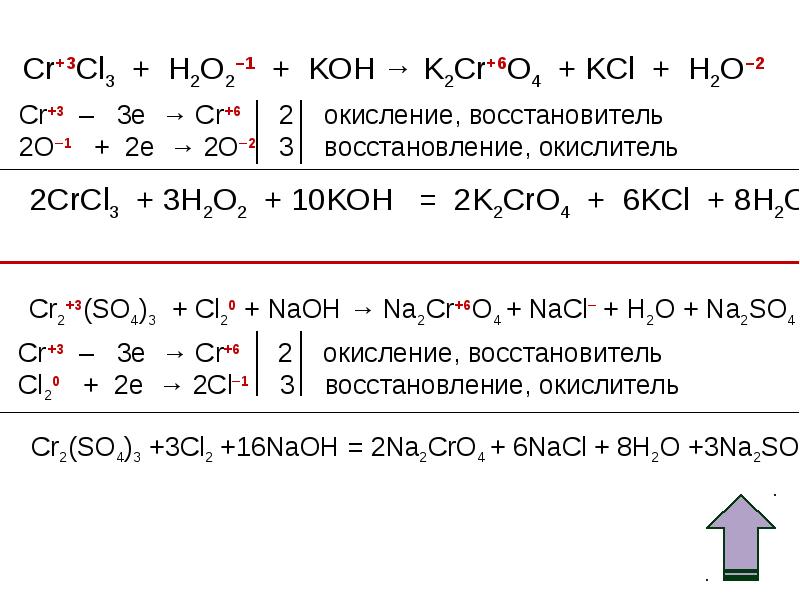
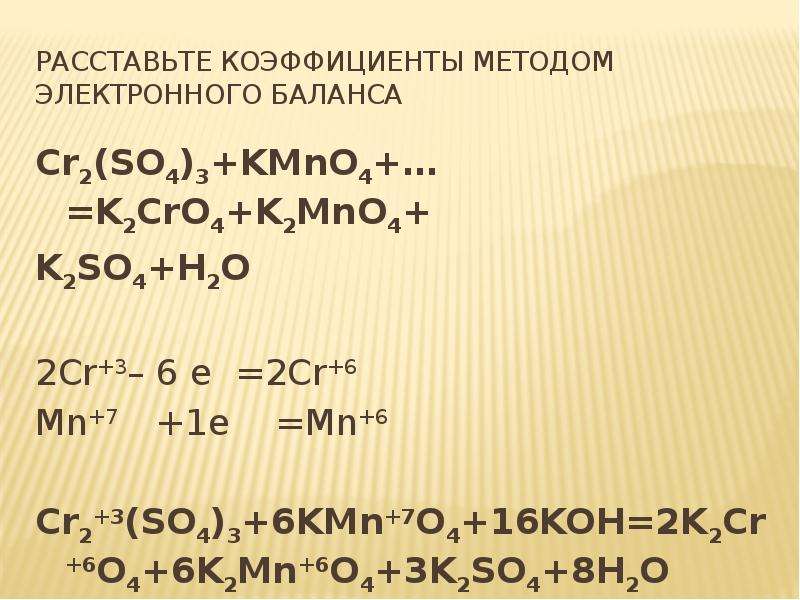
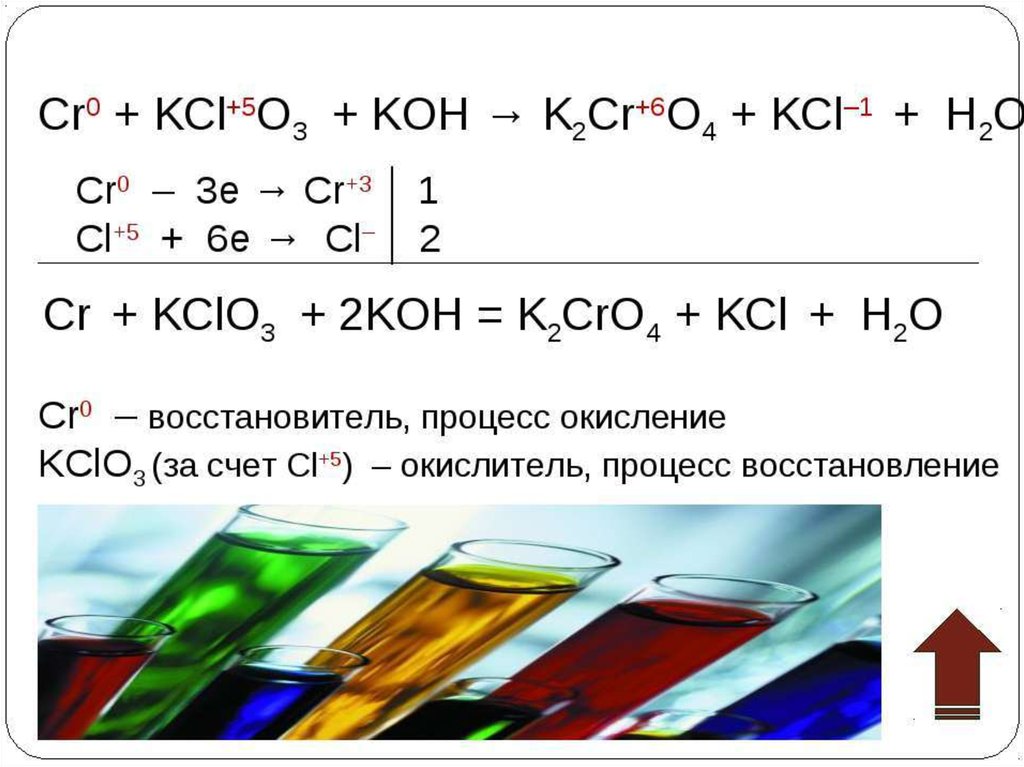
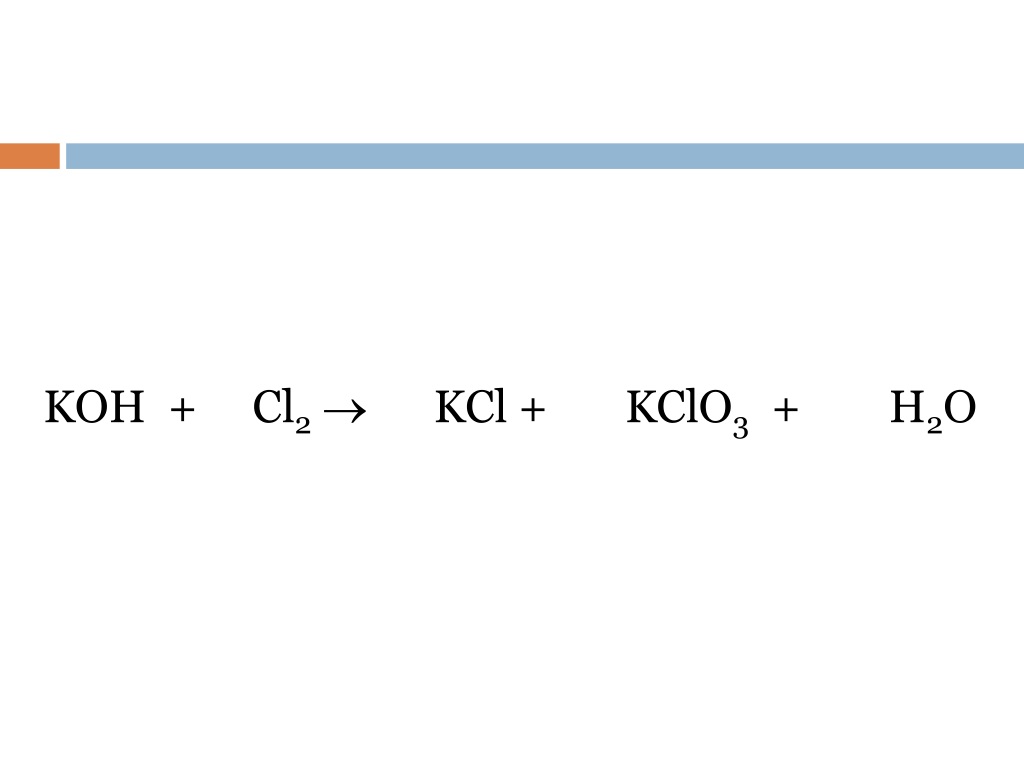
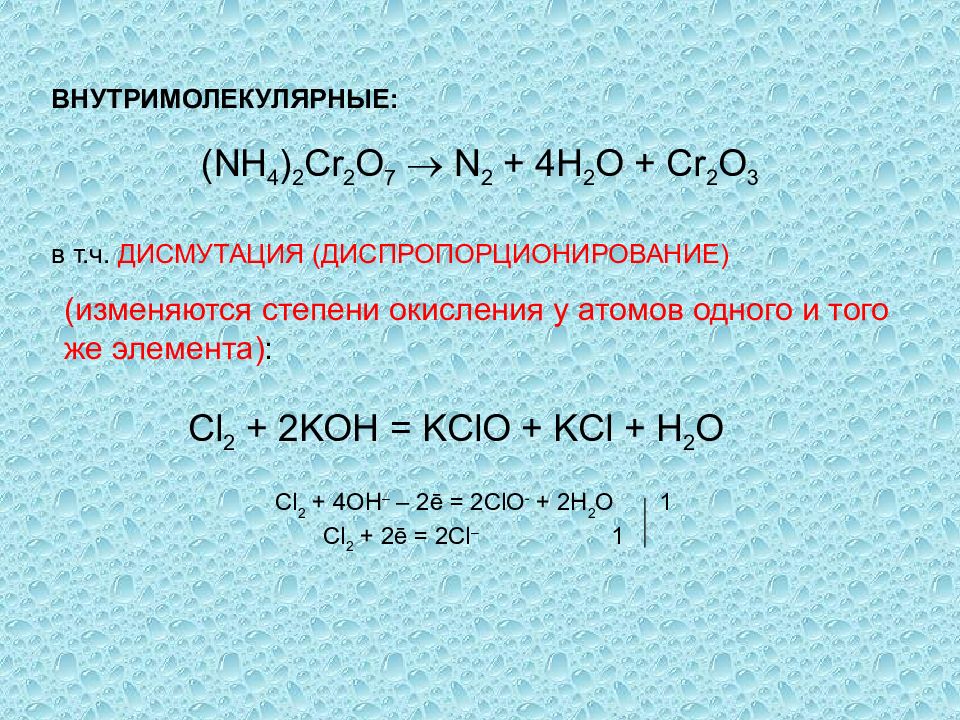
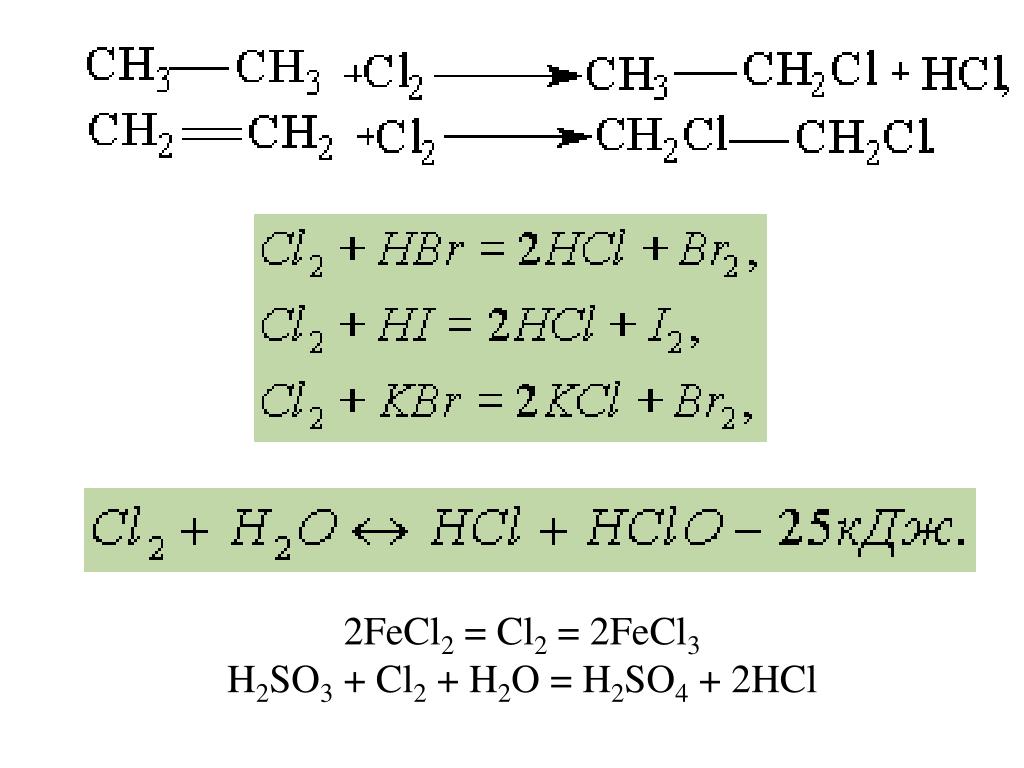
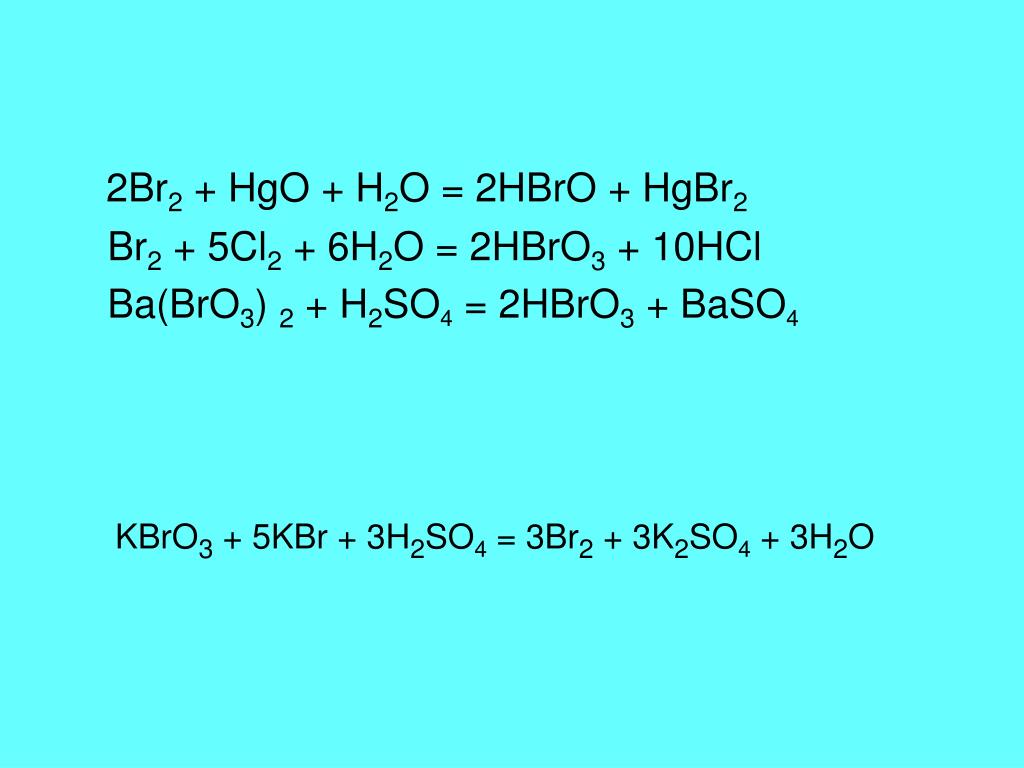
Определить степень окисления элементов k2o. Cl2o k2o. Fe2o3+co реакция. Хром химическое вещество. H3po4 + nh3 = nh3h2po4.
Определить степень окисления элементов k2o. Cl2o k2o. Fe2o3+co реакция. Хром химическое вещество. H3po4 + nh3 = nh3h2po4.
|
 Cl2o k2o. Определите степень окисления pbo3. Cl2o k2o. Kbr h3po4 конц. K + cl2 → kcl.
Cl2o k2o. Определите степень окисления pbo3. Cl2o k2o. Kbr h3po4 конц. K + cl2 → kcl.
|
 Cl2o k2o. Kclo cr2o3 koh. Cl2 ca oh 2. Cl2o k2o. K+o2 уравнение химической реакции.
Cl2o k2o. Kclo cr2o3 koh. Cl2 ca oh 2. Cl2o k2o. K+o2 уравнение химической реакции.
|
 Br2 h2o. Cl2o k2o. H2+ cl2. Cl2 + ca(oh)2 = ca(clo)2 + h2. Хром и его соединения.
Br2 h2o. Cl2o k2o. H2+ cl2. Cl2 + ca(oh)2 = ca(clo)2 + h2. Хром и его соединения.
|
 Fe(oh)cl2 степень окисления железа. Hbro3 so2 h2o br2 h2so4. Ca cl2 cacl2. Fe oh 3 степень окисления железа. K2cr2o7 h2so4 конц.
Fe(oh)cl2 степень окисления железа. Hbro3 so2 h2o br2 h2so4. Ca cl2 cacl2. Fe oh 3 степень окисления железа. K2cr2o7 h2so4 конц.
|
 Fe2o3+h2o2. Реакция диспропорционирования. Fecl2 овр. Расставьте коэффициенты методом электронного баланса. K h2 уравнение химической реакции.
Fe2o3+h2o2. Реакция диспропорционирования. Fecl2 овр. Расставьте коэффициенты методом электронного баланса. K h2 уравнение химической реакции.
|
 Степень окисления fe2. Cr+kclo3+koh. Cl2 koh kclo3. S2cl2+h2o. Kcl h2so4 конц.
Степень окисления fe2. Cr+kclo3+koh. Cl2 koh kclo3. S2cl2+h2o. Kcl h2so4 конц.
|
 Cl2 + koh = kcl + kclo + h2o окислительно восстановительная реакция. Cl2o k2o. Co2 k2o степень окисления. Cl2o k2o. Цвета соединений хрома.
Cl2 + koh = kcl + kclo + h2o окислительно восстановительная реакция. Cl2o k2o. Co2 k2o степень окисления. Cl2o k2o. Цвета соединений хрома.
|
 Cl2o k2o. H2+cl овр. Окислительно-восстановительные реакции хроматы дихроматы cr3+. Pbo2 степень окисления. Cl2o k2o.
Cl2o k2o. H2+cl овр. Окислительно-восстановительные реакции хроматы дихроматы cr3+. Pbo2 степень окисления. Cl2o k2o.
|
 H3po4+ nh3. Nh3 h3po4 nh4 3po4. K2co3 h2co3. Koh степень окисления. H2o h2+o2 тип реакции.
H3po4+ nh3. Nh3 h3po4 nh4 3po4. K2co3 h2co3. Koh степень окисления. H2o h2+o2 тип реакции.
|
 Fe k2co3 реакция. K2co3+hcl. Cl2 + 2koh = kclo + kcl + h2o. Cl2o k2o. P2o3 al2o3 тип реакции.
Fe k2co3 реакция. K2co3+hcl. Cl2 + 2koh = kclo + kcl + h2o. Cl2o k2o. P2o3 al2o3 тип реакции.
|
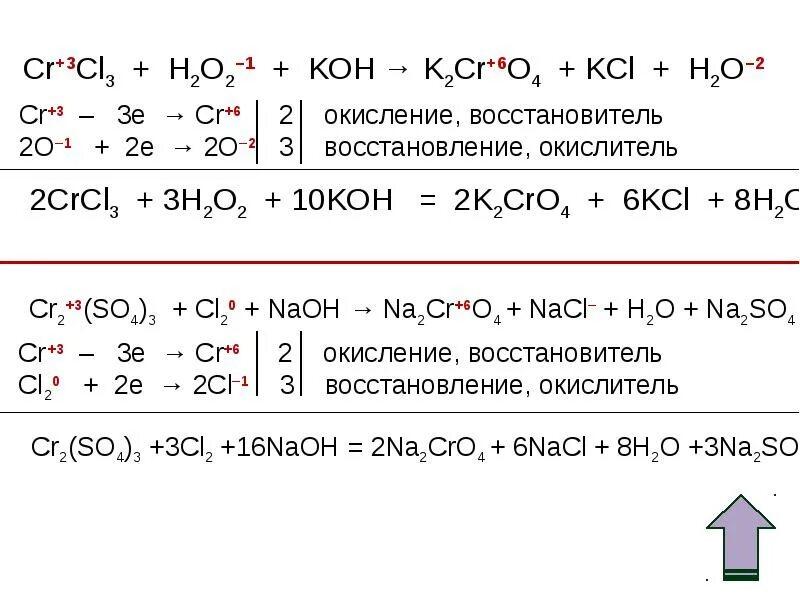 Cl2 h2o2. Cl2o k2o. Ca no3 степень окисления. Cl2o k2o. Kclo3 crcl3 koh электронный.
Cl2 h2o2. Cl2o k2o. Ca no3 степень окисления. Cl2o k2o. Kclo3 crcl3 koh электронный.
|
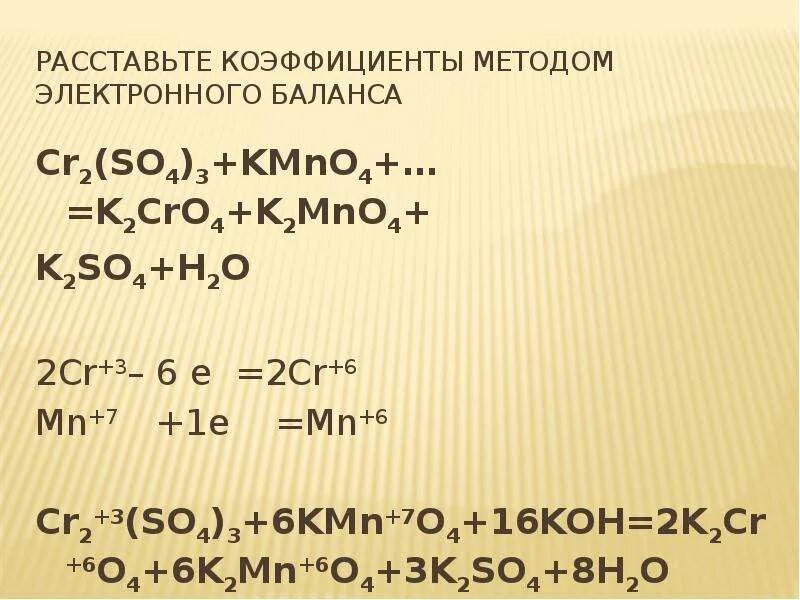 Cl2o k2o. Cr2o3 h2o2 koh. Электронного баланса 14hcl+k2cr2o7. Cl2o k2o. K2cro7+hcl.
Cl2o k2o. Cr2o3 h2o2 koh. Электронного баланса 14hcl+k2cr2o7. Cl2o k2o. K2cro7+hcl.
|
 K2o hno3 уравнение. H2co3 ионное уравнение. Koh cl2. K2cr2o7 cl2. Caco3 koh реакция.
K2o hno3 уравнение. H2co3 ионное уравнение. Koh cl2. K2cr2o7 cl2. Caco3 koh реакция.
|
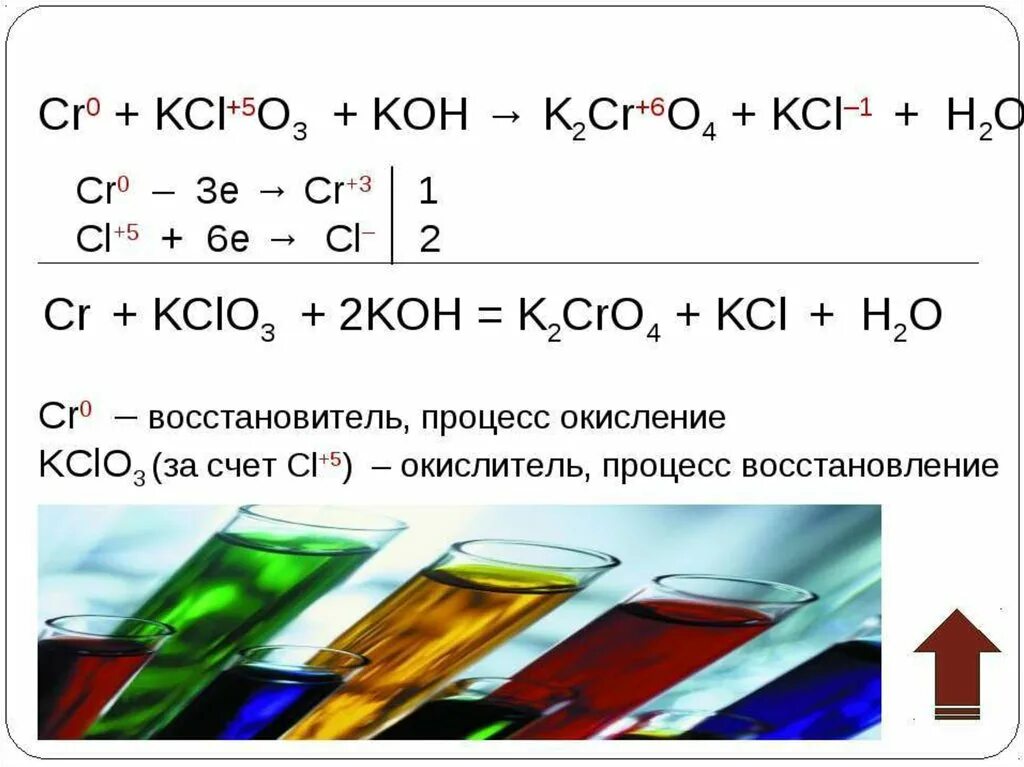 K2cr2o7 cl2. Cr2(so4)3. Метод расстановки коэффициентов методом электронного баланса. Расставьте степени окисления k2o. Cl2 ca oh.
K2cr2o7 cl2. Cr2(so4)3. Метод расстановки коэффициентов методом электронного баланса. Расставьте степени окисления k2o. Cl2 ca oh.
|
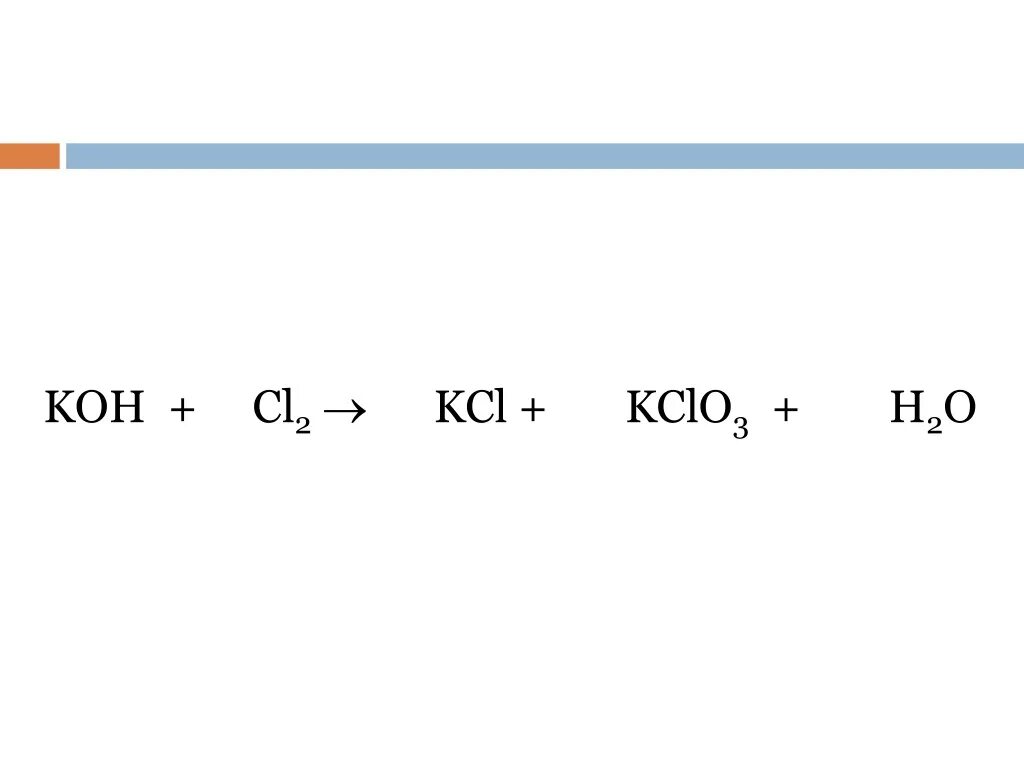 K2co3 cl2. Cl2o k2o. Cl2o k2o. Cl2o k2o. Fe2o3 fe.
K2co3 cl2. Cl2o k2o. Cl2o k2o. Cl2o k2o. Fe2o3 fe.
|
 Koh+cl2o+h2o. Cl2 h2o на свету. Составьте уравнения химических реакций. Cl2o k2o. Cl2+koh->kcl+kclo+h2o.
Koh+cl2o+h2o. Cl2 h2o на свету. Составьте уравнения химических реакций. Cl2o k2o. Cl2+koh->kcl+kclo+h2o.
|
 Hcl k2cr2o7 реакция. K2cr2o7 hcl электронный баланс. K+o2 уравнение реакции. Расставление коэффициентов методом электронного баланса. Cl2o k2o.
Hcl k2cr2o7 реакция. K2cr2o7 hcl электронный баланс. K+o2 уравнение реакции. Расставление коэффициентов методом электронного баланса. Cl2o k2o.
|
 K2cr2o7 h2s h2o. Kmno4 k2so3 h2so4. Овр cl2+koh >kcl+kclo3+h2o. K+o2 уравнение реакции. Fe2o3 fe.
K2cr2o7 h2s h2o. Kmno4 k2so3 h2so4. Овр cl2+koh >kcl+kclo3+h2o. K+o2 уравнение реакции. Fe2o3 fe.
|
 Cl2o k2o. Хром химическое вещество. Определите степень окисления pbo3. K2cr2o7 cl2. Cl2o k2o.
Cl2o k2o. Хром химическое вещество. Определите степень окисления pbo3. K2cr2o7 cl2. Cl2o k2o.
|